Предыдущая Следующая
Если
химическая связь образована двумя
атомами с близкими электроотрицательностями,
то также образуется ковалентная связь. Ковалентность также равна
порядку связи, относящемуся к той его доле, которая
соответствует неполярной ковалентной
связи. Однако часть электронной
плотности химической связи в некоторой
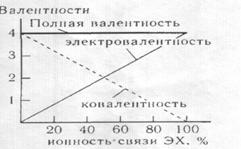
мере смещена Рис.23. Изменение ковалентности и
к более электроотрицательному атому. электровалентности центрального На этом атоме появляется эффективный атома идеализированной молекулы
отрицательный
заряд, а на
менее состава ЭХ4 в зависимости от
ионности
электроотрицательном
- эффективный, химической связи; атом Х одновалентный положительный заряд атома. Величина этого атом, типа Н, F
и т.п.
заряда есть электровалентность атома. Значит, при повышении полярности атома убывает, а электровалентность
– возрастает. В предельном случае полярной связи -ионной — связывающая электронная плотность
полностью смещена к более электроотрицательномуатому. Эффективные заряды на взаимодействующих атомах приобретают
мак симальные по модулю значения, а ковалентная составляющая связи отсутствует.
Таким образом, в ионной связи ковалентность
взаимодействующих атомов – равна
нулю, а электровалентность достигает экстремальных значений (рис. 23).
Рис.23
построен на основании того, что ковалентность атома определяется неполярной составляющей химической
связи, а электровалентность - эффективными
зарядами атомов. Из
рис.23 также видно, что, хотя ковалентность
и электровалентности атомов изменяются различным образом, сумма ковалентности и
модуля электровалентности, т. е. валентность атома остается постоянной.
Для
уравнивания и определения вида возможных продуктов многих химических реакций существует специальный метод, основанный
на понятии степени окисления. Для примера рассмотрим несколько соединений (табл.
20).
Предыдущая Следующая
|