Предыдущая Следующая
-3 +1 -2
+1 -1+1 -2+1
0 +2-2 +1 +3-2
+4-2 +1+5-2
NH3, N2H4,
NH2OH, N2, NO,
NaNO2, NO2, KNO3
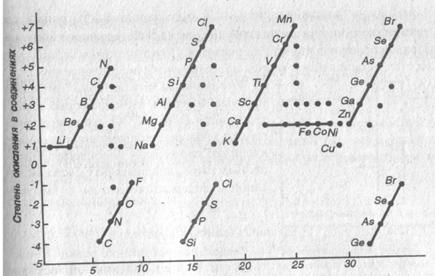
Как видно из рис.24, максимальная, а для неметаллов и минимальная степени
окисления имеют периодическую зависимость от порядкового номера в периодической
системе элементов, что обусловлено электронным строением атомов.
Степень окисления является формализованным отображением общей валентности
элемента в соединении, определяемой суммой его ковалентности и электровалентности.
Степени окисления можно
рассчитать квантовохимически на основании рассмотрения
распределения электронной плотности в молекуле. Однако гораздо раньше для расчета
степеней окисления элемента в его соединениях выработаны простые и удобные эмпирические
правила, не требующие трудоемких квантово-химических расчетов. В краткой форме они
приведены были выше. Рассмотрим их подробнее.
В простых
веществах степень окисления, элемента всегда
равна нулю. Нулевые значения степени
окисления имеют, например, атомы в молекулах водорода (Н2), кислорода
(О2), серы (S3, S4, S6, S8,
... Sn где n обычно
принимает значения порядка постоянной
Авогадро), в чистых металлах (Me) и др.
В простых
веществах только благородных газов, представляющих собой одноатомные молекулы при
н.у., валентность элемента равна нулю. Атомы остальных элементов проявляют ненулевую
валентность
Рис. 24. Наиболее распространенные степени окисления первых
35
например, валентность
элементов. Линиями соединены высшие
и низшие степени окисления углерода в алмазе равна четырем. Однако степень окисления углерода при этом
принимается равной нулю, так как нет преимущественных смещений электронной плотности
между эквивалентными атомами углерода и, следовательно, нет оснований представить
вещество алмаз, состоящим из ионов С4+ и С4– . Поэтому
степень окисления является лишь отображением валентности, но не совпадает с ней.
В сложных соединениях некоторые элементы проявляют всегда одну и ту же степень окисления, но для большинства
элементов она может принимать несколько значений.
8.2. Окислительно-восстановительные реакции. Рассмотрим основные положения теории окислительно-восстановительных
реакций.
Предыдущая Следующая
|