Предыдущая Следующая
1. В кислой среде избыток ионов O+2
образует с ионами H+ молекулы воды:
Изб. O2–+2H+=H2O
2. В нейтральной или щелочной среде избыток ионов O2- образует с молекулами
воды гидроксид – ионы:
Изб. O2–+ H2O=2OH–
3. В щелочной среде недостаток ионов O2– компенсируется двумя ионами
OH-, одновременно образуется одна молекула воды:
2OH–DH2O+O2–
|
Реакциясреды
|
Избыток ионов О2–
|
Недостаток ионов О2–
|
|
окислитель
|
восстановитель
|
|
Кислая
|
Н+ ® Н2О
|
Н2O ® 2Н+
|
|
изб. O2–
+ 2H+ = Н2О
|
Н2О ® 2Н+ + O2–
|
|
Нейтральная
|
H2O ® OH–
|
Н2O ® 2Н+
|
|
изб. О2–
+ Н2О ® 2OН–
|
Н2О ® 2Н+ + О2–
|
|
Щелочная
|
Н2O ® ОН–
|
2OН– ® Н2О
|
|
изб. О2– + Н2O ® 2OН–
|
2OН– ® Н2О + О2–
|
Разберем на конкретных примерах.
Пример 1. Составить уравнение
реакции, которая протекает при пропускании сероводорода
Н2S через подкисленный раствор перманганата калия КМnO4
При протекании реакции малиновая
окраска исчезает и раствор мутнеет. Опыт показывает,
что помутнение раствора происходит в результате образования элементарной серы из
сероводорода:
H2S ® S +2H+
В этой схеме число атомов одинаково в левой
и правой частях. Для уравнивания зарядов надо от левой части схемы отнять два электрона,
после чего можно стрелку заменить на знак равенства:
H2S – 2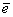 = S+2H+ = S+2H+
Эта первая полуреакция — процесс окисления
восстановителя H2S.
Обесцвечивание раствора связано с
переходом иона МnО-4 (он имеет малиновую
окраску) в ион Mn2+ (почти бесцветный и лишь при большой концентрации
имеет розоватую окраску), что можно выразить схемой
MnO4– ®Mn2+
Опыт показывает, что в кислом
растворе кислород, входящий в состав ионов MnO-4,
вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс
перехода записываем так:
МnО-4 + 8H+ ®Мn2+
+ 4Н2О
Чтобы стрелку заменить на знак
равенства, надо уравнять и заряды. Поскольку исходные вещества
имеют семь положительных зарядов (7+), а конечные - два положительных (2+), то
для выполнения условия сохранения зарядов
надо к левой части схемы прибавить пять электронов:
MnO-4 + 8H++5e- = Mn2++4H2О
Это вторая полуреакция – процесс
восстановления окислителя – иона MnO-4.
Для составления общего (суммарного) уравнения реакции надо уравнение
полуреакций почленно суммировать, предварительно уравнять число отданных и полученных
электронов. В этом случае по правилам нахождения наименьшего кратного определяют
соответствующие множители, на которые умножаются равенства полуреакций. Сокращенно
запись проводится так:
Предыдущая Следующая
|