Предыдущая Следующая
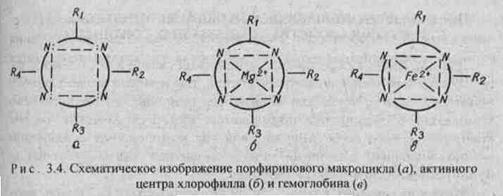
Железо координирует
кислород в комплексе гемоглобина и переносит его по организму с кровью. Связь
кислорода с железом в комплексе не очень прочная и поэтому
кислород в организме легко реагирует с восстановителями. Недостаток железа в организме
приводит к болезни - анемии. Макроциклы крови могут взаимодействовать с каталитическими
ядами, например, монооксидом углерода СО, что приводит к отравлению организма.
Сложные
лиганды-комплексоны широко используются в
энергетике для очистки парогенераторов от накипи, в медицине - для
очистки почек от камней, для выведения ядов из организма,
таких как Hg2+ Pb2+ Cd2+, в химии - как
катализаторы некоторых реакций, например восстановления кислорода, в аналитической
химии, в частности, при определении жесткости воды.
9.8. Комплексонометрия.
Жесткость воды. Жесткость воды выражается суммой
миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды
(ммоль/л). Один миллимоль жесткости отвечает содержанию 20,04 мг/л
Са2+ или 12,16 мг/л Mg2+.
Пример 1. Вычислите жесткость воды, зная, что
в 500 л ее содержится 202,5 г Са(НСО3)2.
Решение. В 1 л воды содержится
202,5 : 500 = 0,405 г Са(НСО3)2,
что составляет 0,405 : 81 = 0,005 ммоль/л. 81 г/моль — эквивалентная
масса Са(НСО3)2. Следовательно, жесткость воды 5ммоль. (Ж = т
/ (mэV)= 202 500 / (81 • 500) = 5 ммоль. 81 – эквивалентная
масса Са(НСО3)2, равная половине его молярной
массы).
Пример 2. Сколько граммов CaSO4
содержится в 1 м3 воды, если жесткость,
обусловленная присутствием этой соли, равна 4 ммоль?
Решение. Молярная масса CaSO4
136,14 г/моль; молярная масса эквивалента равна 136,14:2 = 68,07 г/моль.
В 1 м3 воды жесткостью 4 ммоль содержится 4 · 1000 = 4000 ммоль, или
4000 · 68,07 = 272 280 мг = 272,280 г CaSO4. Из формулы Ж
= m / (mэV),m = 4×68,07×1000 =
272 280 мг = 272,280 г CaSO4).
Пример
3. Какую массу соды надо добавить к
500 л воды, чтобы устранить ее жесткость, равную 5 ммоль?
Решение. В 500 л воды содержится 500 ·
5 = 2500 моль солей, обусловливающих жесткость воды. Для устранения жесткости следует
прибавить 2500 · 53 = 132 500 мг = 132,5 г соды (53 г/моль — молярная масса эквивалента
Na2CO3).
Предыдущая Следующая
|