Предыдущая Следующая
Рис. 8. Схема образования химической связи в молекуле хлора.
с точки зрения строения атома электронная формула атома азота выглядит так:
↑↓ ↑ ↑ ↑
2s 2р
В молекуле азота связь
осуществляется за счет перекрывания трех р-облаков, расположенных
по оси х, у, z. Между атомами азота образуется одна сигма (σ)
-связь и две пи – связи (π).
Связь, образованная при
перекрывании электронных облаков вдоль линии, соединяющей центры
взаимодействующих атомов, называется сигма (σ) - связью. Связь, образованная за счет
перекрывания орбиталей по обе стороны от линии, соединяющей центры – атомов,
называется пи – связью.
Наглядно это представлено на
рисунке 9.
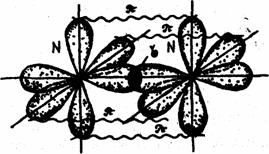
Рис. 9.Схема образования химической связи в молекуле азота.
Мы рассмотрели неполярную или
гомеополярную ковалентную связь. При неполярной связи вероятность
присутствия электронной плотности между ядрами одинакова. Центры тяжести положительных
и отрицательных зарядов совпадают. Центром положительного заряда считают середину
расстояния между ядрами. В молекулах простых газообразных веществ Н2,
CI2, O2, N2 - в газообразной фазе наблюдается
гомеополярная (неполярная) связь.
Вещества с неполярной ковалентной
связью обладают низкими температурами кипения и плавления, в воде
не диссоциируют, не проводят электрический ток.
4.3.2. Полярная ковалентная связь. Образование молекулы из
атомов различных элементов происходит при помощи гетерополярной (полярной) ковалентной
связи. Простейший случай гетерополярной связи — это образование молекулы хлорводорода.
Образование молекулы НС1 можно представить схемой:
. . . .
Н • + • С1 : → Н : С1:
• • • •
Здесь происходит
перекрывание s-облака атома водорода и р-облака атома хлора (рис.
10).
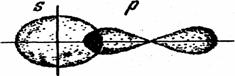
Рис. 10. Схема образования химической связи в молекуле хлороводорода.
Предыдущая Следующая
|