Предыдущая Следующая
Решение. Теплотой образования (энтальпией) данного соединения
называют тепловой эффект реакции образования 1 моль этого соединения из простых
веществ, взятых в их устойчивом состоянии при данных условиях.
Обычно теплоту образования относят к стандартному состоянию, т.е. 25° С
(298 К) и 1,013×105 Па и обозначают через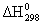 .Так как тепловой эффект с
температурой изменяется незначительно, то в дальнейшем индексы опускаются и тепловой
эффект обозначается через .Так как тепловой эффект с
температурой изменяется незначительно, то в дальнейшем индексы опускаются и тепловой
эффект обозначается через  Н. Следовательно,
нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет
вид Н. Следовательно,
нужно вычислить тепловой эффект реакции, термохимическое уравнение которой имеет
вид
2С(графит)+3Н2(г) = С2Н6(г); ∆H = ?
исходя из следующих
данных:
а) С2Н6(г) + 31/2О2(г)=2СО2(г)+3Н2О(ж); ∆H
=-1559,87 кДж
б) 2С(графит)+О2(г)= СО2(г); ∆H
=-393,51 кДж
в) Н2(г)+ 1/2О2=Н2О(ж); ∆H
=-285,84 кДж
На основании закона Гесса с термохимическими уравнениями можно оперировать
так же, как и с алгебраическими. Для получения искомого результата следует уравнение
(б) умножить на 2, уравнение (в) — на 3, а затем сумму этих уравнений вычитают из
уравнения (а):
С2Н6 + 31/2О2-2С-2О2-3Н2-3/2О2=2СО2+3Н2О-2СО2-3Н2О
∆H =-1559,87-2(-393,51)-3(-285,84)=
+84,67 кДж;
∆H =-1559,87+787,02+857,52;
С2Н6=2С+3Н2; ∆H
= +84,67 кДж
Так как теплота образования равна теплоте разложения с
обратным знаком, то 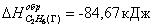 . К тому же результату придем, если
для решения задачи применить вывод из закона Гесса: . К тому же результату придем, если
для решения задачи применить вывод из закона Гесса:
∆Hх.р. =2∆Hсо2+3∆Hн2о-∆Hс2н6-31/2∆Hо2
Учитывая, что теплоты образования простых веществ условно
приняты равными нулю
∆Hс2н6=2∆Hсо2+3∆Hн2о-∆Hх.р.
∆Hс2н6=2(-393,51)+3(-258,84)+1559,87=-84,67;
∆Hобрс2н6(г)=-84,67
кДж
Пример 3. Реакция горения
этилового спирта выражается термохимическим уравнением
С2Н5ОН(ж)+3О2(г)=2СО2(г)+3Н2О(ж); ∆H=?
Вычислите тепловой эффект реакции, если известно, что молярная теплота парообразования
С2Н5OН(ж) равна +42,36 кДж, а теплоты образования С2Н5OН(г),
СO2(г), Н2O(ж) см. табл. 15.
Решение. Для определения  Н реакции необходимо знать теплоту
образования С2Н5OН(ж). Последнюю находим
из данных: Н реакции необходимо знать теплоту
образования С2Н5OН(ж). Последнюю находим
из данных:
С2Н5ОН(ж) = С2Н5ОН(г); ∆H = + 42,36 кДж
+42,36 = - 235,31- ∆Hс2н5он (ж);
∆Hс2н5он (ж) = - 235,31-42,36 = -277,67 кДж
Предыдущая Следующая
|