Предыдущая Следующая
Вычисляем  H реакции, применяя следствие из
закона Гесса: H реакции, применяя следствие из
закона Гесса:
∆Hх.р.=2(-393,51)+3(-285,84)+277,67=-1366,87 кДж
5.5. Химическое
сродство. Энтропия химических реакций. Энергия Гиббса. Самопроизвольно могут протекать
реакции, сопровождающиеся не только выделением, но и поглощением
теплоты.
Реакция, идущая при данной температуре
с выделением теплоты, при другой температуре проходит с поглощением
теплоты. Здесь проявляется диалектический закон единства и борьбы противоположностей.
С одной стороны, система стремится к упорядочению (агрегации), к уменьшению Н; с другой стороны, система стремится
к беспорядку (дезагрегации). Первая тенденция растет
с понижением, а вторая — с повышением температуры. Тенденцию к беспорядку характеризует
величина, которую называют энтропией.
Энтропия S, так же как внутренняя энергия U, энтальпия Н, объем V и др., является свойством вещества,
пропорциональным его количеству. S,
U, H, V обладают аддитивными свойствами, т.е. при соприкосновении системы суммируются.
Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с
увеличением движения частиц: при нагревании, испарении, плавлении, расширении
газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы:
конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация и т.п.—
ведут к уменьшению энтропии. Энтропия является функцией состояния, т.е. ее изменение
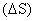 зависит только от
начального (S1) и конечного (S2)
состояний и не зависит от пути процесса: зависит только от
начального (S1) и конечного (S2)
состояний и не зависит от пути процесса:
∆Sx.p.=∑S0прод - ∑S0исх
∆S=S2-S1
если S2>S1, то
∆S>0
если S2<S1, то ∆S<0
(2)
Так как энтропия увеличивается с
повышением температуры, то можно считать, что мера беспорядка равна »T S. Энтропия выражается в
Дж/(моль.К). S. Энтропия выражается в
Дж/(моль.К).
Таким образом, движущая сила
процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку
(TS). При р =
const и Т = const общую движущую силу
процесса, которую обозначают  G, можно найти из соотношения G, можно найти из соотношения
Предыдущая Следующая
|