Предыдущая Следующая
|
Вещество
|
Состояние
|
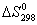 , Дж/(моль.К) , Дж/(моль.К)
|
вещество
|
Состояние
|
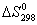 ,Дж/(моль.К) ,Дж/(моль.К)
|
|
С
|
Алмаз
|
2,44
|
Н2O
|
г
|
188,72
|
|
С
|
Графит
|
5,69
|
N2
|
г
|
191,49
|
|
Fe
|
к
|
27,2
|
NН3
|
г
|
192,50
|
|
Ti
|
к
|
30,7
|
СО
|
г
|
197,91
|
|
S
|
Ромб
|
31,9
|
с2H2
|
г
|
200,82
|
|
TiO2
|
к
|
50,3
|
O2
|
г
|
205,03
|
|
FeO
|
к
|
54,0
|
H2S
|
г
|
205,64
|
|
H2O
|
ж
|
69,94
|
NO
|
г
|
210,20
|
|
Fе2О3
|
к
|
89,96
|
CO2
|
г
|
213,65
|
|
NH4C1
|
к
|
94,5
|
C2H4
|
г
|
219,45
|
|
СН3ОН
|
ж
|
126,8
|
Cl2
|
г
|
222,95
|
|
Н2
|
г
|
130,59
|
NO2
|
г
|
240,46
|
|
Fе3O4
|
к
|
146,4
|
РС13
|
г
|
311,66
|
|
СН4
|
г
|
186,19
|
PCl5
|
г
|
352,71
|
|
НС1
|
г
|
186,68
|
|
|
|
Пример 3. На основании
стандартных теплот образования (см. табл. 15) и абсолютных стандартных энтропий
веществ (табл.17) вычислите 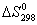 реакции, протекающей
по уравнению реакции, протекающей
по уравнению
СО(г)+Н2О(ж)=СО2(г)+Н2(г)
Решение.  G0 = G0 =  H0 - T H0 - T S0; S0;  H и H и  S – функции состояния, поэтому S – функции состояния, поэтому
∆Н0х.р.=∑
∆Н0прод - ∑
∆Н0исх ; ∆S0x.p.=
∑S0прод - ∑ S0 исх
∆Н0х.р.=(-393,51+0)
– (110,52 – 285,84) = +2,85 кДж
∆S0x.p.=(213,65+130,59)-(197,91+69,94) = +76,39 =
0,07639 кДж/(моль•К);
∆G0= +2,85 – 298 • 0,07639 = - 19,91 кДж
Пример 4. Реакция восстановления
Fе2О3 водородом протекает по
уравнению
Fe2O3(к)+3H2(г) = 2Fe(к)+3H2O(г) ; ∆Н=+96,61 кДж
Возможна ли эта реакция при стандартных условиях, если изменение энтропии
 S=0,1387 кДж/(моль×К)? При
какой температуре начнется восстановление Fе2О3? S=0,1387 кДж/(моль×К)? При
какой температуре начнется восстановление Fе2О3?
Решение. Вычисляем  G0 реакции: G0 реакции:
∆G = ∆Н-Т∆S =
96,61 – 298 • 0,1387 = +55,28 кДж
Так как  G > 0, то реакция при стандартных условиях
невозможна; наоборот, при этих условиях идет обратная реакция
окисления железа (коррозия). Найдем температуру, при которой G > 0, то реакция при стандартных условиях
невозможна; наоборот, при этих условиях идет обратная реакция
окисления железа (коррозия). Найдем температуру, при которой G=0: G=0:
∆Н 96,61
∆Н =Т∆S;
Т = = =
696,5 К
Предыдущая Следующая
|