Предыдущая Следующая
S – площадь поверхности.
Это величины постоянные. Обозначим произведение постоянных величин через
k1, получим 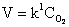 т.е. скорость реакции
пропорциональна только концентрации кислорода. т.е. скорость реакции
пропорциональна только концентрации кислорода.
6.3.Влияние температуры на скорость реакции. Зависимость скорости
реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10 градусов скорость
большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением
t2 – t1
υt2= υt1γ 10
где: 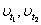 - скорости реакции соответственно при
началом (t1) и конечной (t2)
температурах; - скорости реакции соответственно при
началом (t1) и конечной (t2)
температурах;
γ – температурный
коэффициент скорости реакции, который показывает, во сколько
раз увеличится скорость реакции с повышением температуры реагирующих веществ на
10 градусов.
Дадим иную формулировку уравнения (1). Примем скорость реакции при начальной
температуре (например, при 300°С) за 1 и будем выражать с помощью уравнения
(1) скорость реакции 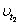 , определяя ее для разных температур
(с интервалом в 10°). Тогда получим: , определяя ее для разных температур
(с интервалом в 10°). Тогда получим:
t 
Арефметическая 300
20 = 1 Геометрическая
прогрессия 310 21 =
2 прогрессия
320 22 = 4
330 23 =
8
340 24 = 16…
400 210 = 1024
Из этого легко вывести следующее
правило: при повышении температуры в арифметической
прогрессии скорость реакции возрастает в геометрической прогрессии.
Температура влияет на скорость реакции, увеличивая константу скорости. Отношение,
показывающее, во сколько раз увеличилась константа скорости при увеличении температуры
на 10°, называется температурным коэффициентом скорости
реакции, т.е.
k t+10
γ =
k t
где: γ – температурный коэффициент скорости;
Предыдущая Следующая
|