Предыдущая Следующая
а = γс
где γ – коэффициент активности,
который формально учитывает все виды взаимодействия частиц в данном
растворе, приводящие к отклонению от
свойств идеального раствора.
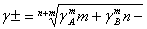
Например, для раствора
КС1
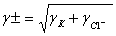
для раствора А12(SO4)3
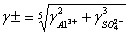
Коэффициенты
активности зависят от природы растворителя и растворенного вещества,
от концентрации раствора, а также от температуры (табл. 18).
Таблица 18
Коэффициенты активности
некоторых электролитов
в растворах при
298 К
|
КонцентрациямольгНО
|
Коэффициент активности для электролитов
|
|
NaCl
|
KCl
|
NaOH
|
KOH
|
HCl
|
H2SO4
|
CaCl2
|
|
0,001
0,01
0,1
0,5
1,0
2,0
5,0
|
0,965
0,874
0,778
0,681
0,657
0,668
0,874
|
0,966
0,901
0,769
0,651
0,607
0,576
-
|
0,966
0,900
0,776
0,693
0,679
0,700
1,060
|
0,966
0,900
0,766
0,712
0,735
0,683
1,670
|
0,966
0,904
0,796
0,758
0,809
1,010
2,380
|
0,830
0,544
0,265
0,156
0,132
0,128
0,208
|
0,840
0,580
0,518
0,448
0,500
0,792
0,890
|
Как видно
из табл. 18 коэффициенты активности меняются в очень широких пределах: в
области разбавленных растворов они стремятся к единице, в то время как в области
высококонцентрированных растворов они могут
достигать единиц, десятков и даже сотен. В области
разбавленных растворов (ниже 0,1 моль/л) коэффициенты активности зависят главным
образом от концентрации и заряда ионов, присутствующих в растворе, и мало зависят
от природы растворенных веществ. Эта закономерность известна в теории растворов
иод названием правила ионной силы. Согласно этому правилу, ионы одинаковой
зарядности, независимо от их природы, в разбавленных растворах с одинаковой ионной
силой имеют равные коэффициенты активности. Ионной силой раствора называется полусумма произведений
концентраций всех ионов, присутствующих в растворе, на квадрат их заряда:
I = 0,5 Σ cizi2 (3)
Правило ионной
силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных
растворах. Коэффициенты активности ионов уменьшаются с увеличением ионной силы растворов
и заряда ионов.
Коэффициенты активности
позволяют, используя простейшие соотношения,
быстро и легко рассчитать реальные свойства растворов. Для расчета константы равновесия любого обратимого
процесса, протекающего в растворе, вместо концентраций используются соответствующие активности. Так,
для обратимого процесса
Предыдущая Следующая
|