Предыдущая Следующая
Переносу диоксида серы на дальние расстояния
способствует строительство высоких дымовых труб. Это возможно и снижает степень
локального загрязнения, но увеличивает время пребывания SO2 в
воздушной среде и степень его превращения в серную кислоту и сульфаты. Таким
образом, сернистый газ в сочетании с парами воды (туман) является главным
компонентом так называемого сернистого смога (смог лондонского типа).
Кислотные дожди. В результате
антропогенного загрязнения атмосферы сернистым газом и оксидами азота
происходит, как показано выше, образование серной и азотной кислот, выпадающих
на Землю вместе с осадками. Кислотность обычной дождевой воды за счет
частичного растворения во влаге углекислого газа равна 5,6: рН = 5,6. Но
известны случаи выпадения кислых дождей с рН = 2,3 (кислотность лимонного
сока!). Такие осадки наносят существенный ущерб качеству воды в природных водоемах,
качеству почвы, приводят к разрушению изделий из металлов, архитектурных
сооружений, мрамора и бетона.
Ежегодно с осадками выпадают миллионы тонн
кислот, что ведет к радикальному изменению химии природной среды. Частицы
сульфатов размером 0,1 - 1 мкм, присутствующие в атмосфере, рассеивают свет,
ухудшая видимость, что отрицательно воздействует на организм человека. В условиях
повышенной влажности и гигроскопичности некоторых сульфатов: (NH4)2SO4,
NH4HSO4 – рассеивание света возрастает.
7.4.
Источники загрязнения атмосферы
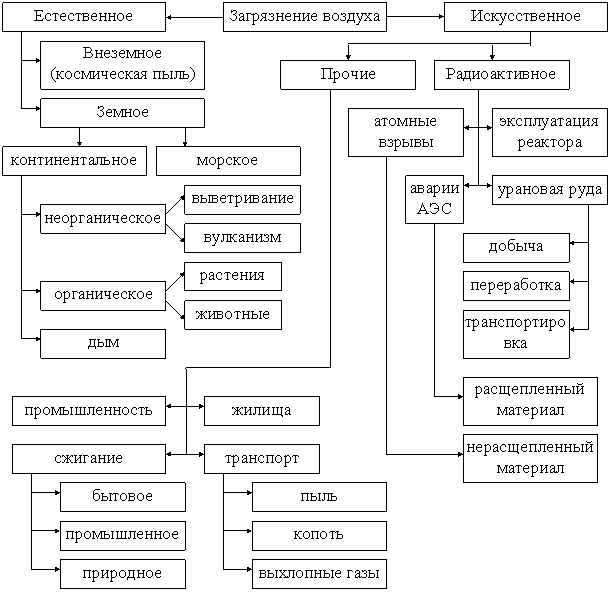
Существует два вида загрязнений атмосферы:
естественное и искусственное, каждый обусловлен соответствующими источниками
(рис. 7.1). Источники загрязнения атмосферы различаются также по мощности выброса
(мощные, крупные, мелкие), высоте выброса (низкие, средней высоты и высокие),
температуре выходящих газов (нагретые и холодные).
Для подготовки исходных данных для расчета предельно допустимых
выбросов (ПДВ) предприятия для каждого источника по каждому показателю
требуется классификация не только источников загрязнений, но также
классификация и характеристика выбросов, степень изученности и учет в расчетах.
При этом учитывают организованные, неорганизованные и распределенные выбросы
(рис. 7.2).
Предыдущая Следующая
|