Предыдущая Следующая
f=1
Параллельно
контрольный опыт
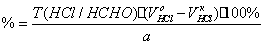
3) Окисление перекиси
– алкалиметрия в присутствии пергидроля.
HCHO + H2O2
+ NaOH(изб)  HCOONa + 2H2O HCOONa + 2H2O
Избыток NaOH
оттитровываем HCl.
Индикатор – ФФ или
БТС
f=1
Контрольный опыт
4) Гидроксиламиновый
HCHO + NH2OH•HCl à H2C=N-OH + HCl
HCl
титруют NaOH.
Индикатор БТС.
f=1
Расчетная формула без
контрольного опыта.
4) Рефрактометрия
5) Спектрофотометрия
Применение: Антисептик, дезинфектант
Хранение: в склянке оранжевого
стекала при температуре не менее 9 С.
Рецептура: Если раствор формальдегида, то исходят из фактической
концентрации (37%). Если раствор формалина, то 37% раствор принимают за 100% и
уже исходя из этого готовят разведение
При вдыхании -
отравление, слезоточивость, кашель. При употреблении внутрь – тошнота, понос.
Chlorali hydras – 2,2,2трихлорэтандиол
1,1. Cl3C-CH(OH)2
Описание: бесцветные прозрачные кристаллы с характерным
запахом, на воздухе улетучивается, гигроскопичен, легко растворим в воде,
спирте, эфире и CHCl3
Подлинность:
1. Гидролиз щелочной
при комнатной температуре. Растворяем в воде, добавляем щелочь, взбалтываем.
Образуется мутная жидкость с характерным запахом хлороформа.
Cl3C-CH(OH)2 + NaOH à CHCl3 + HCOONa + H2O
2. С реактивом
Толленса. Образуется черный осадок серебра. Мгновенная реакция.
Cl3C-CH(OH)2 + [Ag(NH3)2]NO3
à Ag¯ + Cl3-C-COOH + NH3 +
NH4NO3
Нефармакопейные:
1. Реакция
конденсации с фенольными соединениями в щелочной среде.
Cl3C-CH(OH)2 + NaOH à CHCl3 + HCOONa + H2O
CHCl3 + NaOH à CCl2 (дихлоркарбен) + NaCl + H2O
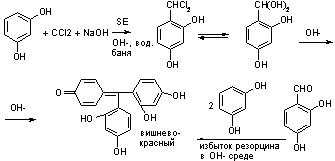
При нагревании с
резорцином в щелочной среде. Аналогично - с фенолом и тимолом.
Чистота: прозрачность и цветность, кислотность (МО должен
быть желтым), органические примеси (обнаруживают по реакции с
концентрированной H2SO4).
Общедопустимые
примеси: хлориды и тяжелые металлы.
Специфические недопустимые: хлоральалкоголят (он же моноэтилацеталь
хлоральгидрата). Не должно быть осадка и запаха йодоформа при нагревании с
йодом в щелочной среде. Йодоформная проба (выпадает желтый кристаллический
осадок с характерным запахом):
Cl3C-CH(OH)-OC2H5 + NaOH  C2H5OH + Cl3C-CH(OH)2 C2H5OH + Cl3C-CH(OH)2
C2H5OH
+ 4I2 + 6NaOH 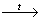 CHI3¯ + HCOONa CHI3¯ + HCOONa
КО:
Обратная Алкалиметрия.
Cl3C-CH(OH)2 + NaOH изб à CHCl3 + HCOONa
Предыдущая Следующая
|