Предыдущая Следующая
При расчете рН слабых электролитов обычно принимают, что ан+ ≈ [Н+]. В
этом случае
PH ≈ -lg [Н+].
(12)
Концентрация ионов
водорода в растворе слабых кислот определяют по уравнениям Оствальда (1) или (2), (2а, б)
[h+] = ас= 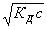
Аналогично определяют концентрацию ионов
гидроксида:
[OH – ]
= ac = 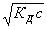
значения рН в этом случае находят по
уравнению (11).
Пример 1. Определите концентрацию ионов ОН – в
0,01 М NH4OH. Рассчитайте рН этого раствора при 295 К.
Решение. Гидроксид
аммония - слабый электролит и диссоциирует обратимо: NH4OH ↔ NH4+ + ОН –. В
соответствии с законом Оствальда степень диссоциации а равна:
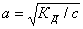
Подставляя значение КД,
получаем:
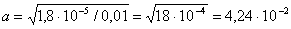
Равновесная концентрация ионов ОН
– равна:
[ОН– ] = ас = 4,24 •10– 2 • 10– 2 = 4,24 • 10 – 4 моль/л.
Водородный показатель равен:
рН = рКВ - рОН
Можно считать, что в
растворе слабого электролита активность ионов равна их концентрации. Тогда
рОН =
-lg [ОН–] = -lg 4,24 • 10 – 4 = 3,37
Соответственно рН = 14 - 3,37 =
10,63
Расчет рН сильной
кислоты проводят по уравнениям (7), (9) и (11).
Для этого необходимо определить ионную силу по уравнению (3) и коэффициент активности
ионов водорода или гидроксида по табл. 18.
Пример 2. Рассчитайте рН
раствора, содержащего 0,01 моль/л НС1 и 0,01 моль/л СаС12.
Решение. Так
как НС1 и СаС12 сильные электролиты, то
они диссоциируют полностью:
НС1 → Н+
+ С1– ,
CaCl2 → Са2+
+ 2С1–
Соответственно рН раствора определяем по формуле:
рН = -1g ан+= -1gγн+[н+]
Для расчета
коэффициента активности необходимо определить ионную силу раствора:
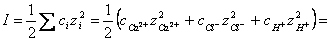 1/2[0,01•4+(0,02+0,01)12+0,01•12]
= 0,04 1/2[0,01•4+(0,02+0,01)12+0,01•12]
= 0,04
На На основании табл. 18 путем
интерполяции находим γн+ = 0,86, следовательно,
pH = -lg (0,86 • 0,01) = 2,07
7.4. Гидролиз солей. Химическое обменное взаимодействие
ионов растворенной соли с водой, приводящее к образованию слабодисcоциирующих продуктов
(молекул слабых кислот или оснований, анионов кислых или катионов основных солей)
и сопровождающееся изменением рН среды, называется гидролизом.
Предыдущая Следующая
|