Предыдущая Следующая
применяют оба варианта изображения: а) и б):
Для правильного расположения электронов на орбиталях необходимо знать правило Гунда: электроны в подуровне располагаются
так, чтобы их суммарный спин был максимальным. Иными словами,
электроны прежде по одному занимают все свободные ячейки данного подуровня.
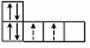
Например, если необходимо разместить три p-электрона (p3)
в p-подуровне, который всегда имеет три орбитали, то из двух возможных вариантов правилу
Гунда отвечает первый вариант:
|
|

|

|
|
+½+½+½=3/2
|
+½-½+½=½
|
В качестве примера рассмотрим графическую электронную схему атома углерода:
6C·1s22s22p2
Количество неспаренных электронов в атоме – очень важная характеристика.
Согласно теории ковалентной связи, только неспаренные электроны могут образовывать
химические связи и определяют валентные возможности атома.
Если в подуровне имеются свободные энергетические состояния (незанятые орбитали),
атом при возбуждении «распаривает», разъединяет спаренные электроны, и его валентные
возможности повышаются:
6C· 1s22s22p3 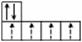
Углерод в нормальном состоянии 2-х-валентен, в возбужденном – 4-х-валентен.
Атом фтора не имеет возможностей для возбуждения (т.к. все орбитали внешнего электронного
слоя заняты), поэтому фтор в своих соединениях одновалентен.
Пример 1. Что такое квантовые
числа? Какие значения они могут принимать?
Решение. Движение электрона в
атоме имеет вероятностный характер. Околоядерное пространство,
в котором с наибольшей вероятностью (0,9-0,95) может находиться электрон, называется
атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется
тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml). Квантовые числа принимают
не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых
чисел различаются на единицу. Квантовые числа определяют размер (n), форму (l) и
ориентацию (ml) атомной орбитали в пространстве. Занимая ту или иную атомную
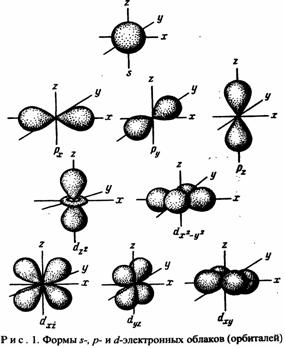
орбиталь, электрон образует электронное облако, которое у электронов одного и того
же атома может иметь различную форму (рис. 1). Формы электронных облаков аналогичны
АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется
четырьмя числами (n, l, m1 и m5).
Предыдущая Следующая
|