Предыдущая Следующая
Известно что ПАБК обладает сходством по структуре с
сульфаниламидами, что позволяет использовать их в качестве эффективных ингибиторов
роста и дальнейшего развития микроорганизмов, т.е. они начинают усваивать
сульфаниламиды и погибают (теория конкурентного антогонизма).
В 1935 году в СССР под руководством академика Магидсона
было впервые налажено получение белого и красного стрептоцида.
Классификация
сульфаниламидов.
I. Химическая
Если заместить первичную амино-группу на CH3COOH или другие –
эффективность пропадает. Если перместить амино-группу в орто- или мета-
положение – эффективность также пропадает.
В амино-, как и в сульфо-группу можно вводить
заместители:

R1 = -SO2- сульфанил
R1
= -SO2-NH- сульфамидо
R1
= -SO2-NH2 сульфамаил
1. Средства, имеющие в положении R1=H, в R2=различные алифатические заместители.

2. Производные, у которых R1=H, а в R2 у них гетероцикл.

3. Препараты в R1=амид, R2=гетероциклы
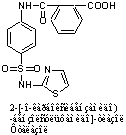
4. Средства имеющие азосоединение вместо NH2. Эти
соединения являются пролонгированными версиями сульфаниламидов.

II. Фармакологическая
Основана на способности сульфамидов выводиться из
организма во времени:
|
Наименование длительности действия
|
Примеры сульфаниламидных препаратов
|
Падение концентрации на 50%, ч
|
Время полного выведения из организма, ч
|
|
Короткого
|
Стрептоцид, Норсульфазол
|
4 – 8
|
16
|
|
Среднедлительного
|
Сульфазин
|
8 – 16
|
16 – 24
|
|
Длительного
|
Сульфодиметоксим
|
24 – 48
|
34 – 56
|
|
Сверхдлительного
|
Сульфален
|
7 дней
|
10 дней
|
Необходимо первые дозы приёма сульфаниламидов увеличить в
2 – 3 раза (ударная доза). Она необходима чтобы следующие дозы были поддерживающими.
III. В зависимости от области
применения:
1. На микроорганизмы лёгких.
2. На кишечник (фталазол).
3. Мочевыводящих путей (уросульфан).
4. Микрофлору глаз (сульфацил натрия).
Синтез
сульфаниламидных препаратов
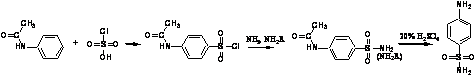
Общее описание:
Сульфаниламидные препараты представляют собой белые или белые с желтоватым
оттенком кристаллические вещества без запаха. Исключением является сульфапиридазин,
имеющий жёлтую окраску, и салазопиридазин – оранжевого цвета порошок.
Общие
реакции подлинности:
1. На свободную аминогруппу:
а.
Диазотирование – азосочетание:

б.
Лигниновая проба:
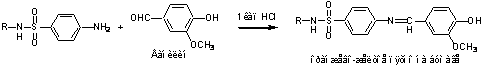
2. С Br2,
I2:
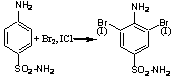
3. На сульфогруппу. Мокрая минерализация: Предыдущая Следующая
|