Предыдущая Следующая
2. Синее окрашивание
с дифениламином
RONO2 + 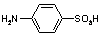 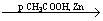 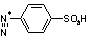

Примеси: частные специфические – этиленгликоля динитрат (ТСХ)
Количественное определение:
1.Обратная
алкалиметрия:
НГ + 5KOH 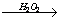 CH3COOK + HCOOH + KNO3 + 2KNO2 + 3H2O CH3COOK + HCOOH + KNO3 + 2KNO2 + 3H2O
Избыток КОН
оттитровывают HCl с индикатором крезоловым
красным или бромкрезоловым пурпурным.
f=1/5; 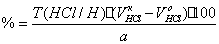
2. Фотоколориметрия:
Нитроглицерин 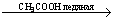 Глицерин + 3HNO3 Глицерин + 3HNO3

 желтая
окраска желтая
окраска
Измеряют D при 408-410 нм, результаты сравнивают с KNO3 по
графику.
3. Спектрофотометрия
4. Со сплавом Деварда
(Cu-50%, Al-45%,Zn-5%):
Нитроглицерин + NaOH à Глицерин + 3NaNO3
NaNO3 + 4Zn + NaOH à NH3 + Na2ZnO2 + H2O
2NH3 + H2SO4 изб à (NH4)2SO4
избыток H2SO4
оттитровываем щелочью с метиленовым красным. f=1/3. Контроль.
Препараты карбоновых кислот и их
солей
RCOOH(Me, R’) – увеличение
растворимости, уменьшение токсичности, Н обеспечивает раздражающее действие и
антимикробную активность.
Получение: 1. Окислением спиртов 2. Из галогенпроизводных УВ.
Физические свойства: от подвижной жидкости через
вязкие до твердых веществ
Растворимость: падает с увеличением Mr, в спирте хор. растворимы, для солей – наоборот.
Химические свойства:
1. Кислотность: Ка =
10-4-10-5. Способны образовывать соли с Ме, оксидами Ме,
растворами едких щелочей, гидроксидами Ме, карбонатами Ме. Соли подвергаются гидролизу
– рН>7.
2. Образуют
комплексные соединения с солями тяжелых Ме – Fe(III), Cu(II).
3. Вступают в реакции
этерификации
Препараты:
Kalii acetas. Калия ацетат. CH3COOK
Описание: Белый, кристаллический порошок со слабым запахом
уксусной кислоты, гигроскопичен, на воздухе расплываются.
Растворимость: ОЛР в воде, ЛР в спирте.
Подлинность:
CH3COO- + C2H5OH 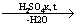 CH3COOC2H5 Запах CH3COOC2H5 Запах
7CH3COO- + 3FeCl3 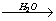 2(CH3COO)3Fe•Fe(OH)2(CH3COO) + 7Cl- + 2HCl красный цвет. 2(CH3COO)3Fe•Fe(OH)2(CH3COO) + 7Cl- + 2HCl красный цвет.
Чистота: допускаются общие примеси, OH-, недопустима примесь восст-щих веществ.
Количественное определение:
1. Неводное
титрование в ледяной уксусной кислоте. Титрант – раствор HClO4 в
ледяной уксусной, индикатор – кристаллический
фиолетовый.
HClO4 + CH3COOH
« ClO4- + CH3COOH2+
CH3COOK
« CH3COO- + K+
CH3COO-
+ CH3COOH2+ à 2CH3COOH
K+
+ ClO4-« KClO4
f=1; 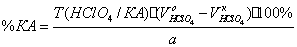
2. Нефармакопейный метод: прямая ацидиметрия с индикатором
треополином 00:
CH3COOK + 0,1M HCl à CH3COOH + KCl
Предыдущая Следующая
|