Предыдущая Следующая
Концентрация
кислоты, оставшейся в недиссоциированном состоянии, будет равна с – ас2 = с (1 - а). Подставив значения равновесных концентраций
ионов и кислоты в уравнение (1), получим:
[Н+] [СН3СОО –]
КД =
[СН3СООН]
а2 с2 а2 с а2
КД = = =
с (1 – а) 1 – а (1 – а)V (1)
где: V= 1/с
са2
или КД =
1 – а
Уравнение (1) было
получено Оствальдом и называется законом Оствальда.
Если а
« 1, то уравнение упрощается:
КД ≈ а2с (2а)
и
a ≈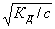 (26) (26)
Уравнение (2а, 2б)
называется законом разбавления Оствальда.
Из него следует, что степень диссоциации уменьшается с увеличением концентрации
слабого электролита. Аналогичное уравнение можно получить для слабого основания.
Многоосновные слабые
кислоты и основания диссоциируют ступенчато,
причем константа диссоциации по каждой последующей ступени всегда на несколько порядков
ниже, чем по предыдущей.
7.3.3.Сильные электролиты. Многие свойства растворов, такие, как осмотическое давление, температура
кипения и замерзания, давление насыщенного пара, зависят как от концентрации раствора,
т. е. от числа растворенных в нем частиц, так и от взаимного влияния этих частиц
друг на друга. Степень взаимодействия частиц в растворе тем выше, чем больше плотность
их зарядов и чем меньше среднее расстояние между ними.
В растворах слабых
электролитов взаимодействие ионов друг с другом относительно невелико вследствие их незначительной концентрации.
Сильные электролиты в растворах диссоциированы практически полностью. Поэтому в
уравнении диссоциации электролита стрелка указывает только на прямой процесс, например:
Предыдущая Следующая
|