Предыдущая Следующая
Периодом называется горизонтальный ряд
элементов, начинающийся щелочным металлом и заканчивающийся
инертным газом. Исключение из этого правила представляет самый короткий I период, начинающийся
водородом. Период это последовательный ряд элементов, размещенных в порядке
возрастания заряда ядра атомов, электронная конфигурация которых
изменяется от ns1 до ns2 np6
(или до ns2 у первого периода). Периоды
начинаются с s- элемента и заканчиваются
p- элементом (у первого периода s- элементом). Малые периоды
содержат 2 и 8 элементов, большие периоды
– 18 и 32 элемента, седьмой период остается незавершенным.
В периодической системе строго
соблюдается ряд закономерностей, связанных со строением электронных
оболочек атомов. Эти закономерности таковы:
- Число электронных слоев в атоме элемента равно номеру периода,
в котором данный элемент находится. Например, у атома H и He всего один электронный
слой, у атома C – два электронных слоя, у атома
Cl – три, у атома Fr – семь и т.д.
- Для элементов главных подгрупп число электронов во внешнем электронном
слое атома равно номеру группы, в которой находится данный элемент. Например, атом натрия
находится в I группе и имеет 1 электрон в наружном слое, атом кремния находится
в IV группе и имеет 4 электрона в наружном слое, атомы инертных газов
расположены в VIII группе и имеют 8 внешних электронов.
Электроны (1-7) незавершенного внешнего слоя участвуют в образовании химических
связей и являются валентными.
В побочных подгруппах распределение валентных электронов более сложное, чем
в главных подгруппах. Общее число подвижных валентных электронов также равно номеру
группы, но только 2 (реже 1) из них находятся во внешнем слое, а остальные помещаются
в предпоследний слой. Например, в атоме марганца (элемент 7-й группы периодической
системы) электроны распределены следующим образом:
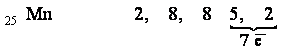
- В периодической системе сверху вниз по группе увеличивается металлическая
активность элементов, т.е. способность отдавать электроны
(поскольку с ростом порядкового номера растет число электронных
слоев и ослабевает связь внешних электронов с ядром).
- В периодической системе слева направо по периоду увеличивается
неметаллическая активность, т.е. способность принимать
электроны (поскольку с ростом порядкового номера увеличивается число
электронов во внешнем электронном слое, отдавать их становится все труднее, более
выгодной будет тенденция дополнить внешний слой до устойчивой восьми электронной
оболочки).В соответствии с вышеприведенными закономерностями самым активным металлом
является франций, самым активным неметаллом является фтор. Вблизи диагонали, разделяющей
эти два полюса, расположены элементы переходного и амфотерного характера: бор, алюминий,
германий, мышьяк, теллур, астат и др. Необходимо уметь свободно ориентироваться
в закономерностях периодической системы; по месту нахождения элемента в таблице
рассказать о его свойствах, характерных валентных состояниях, важнейших соединениях.
Предыдущая Следующая
|