Предыдущая Следующая
∆Hx.p. = ∑∆Hобрпрод - ∑∆Hобрисх (1)
Пример 1. При взаимодействии кристаллов
хлорида фосфора (V) с парами воды образуется жидкий РОС13
и хлороводород. Реакция сопровождается выделением 111,4 кДж
теплоты. Напишите термохимическое уравнение этой реакции.
Решение. Уравнения реакций, в
которых около символов химических соединений указываются их агрегатные
состояния или кристаллическая модификация, а также числовое значение тепловых эффектов,
называют термохимическими. В термохимических
уравнениях, если это специально не оговорено, указываются значения тепловых
эффектов при постоянном давлении Qp, равные изменению
энтальпии системы  Н. Значение Н. Значение  Н приводят обычно в правой части
уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные
обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к — кристаллическое.
Эти символы опускаются, если агрегатное состояние веществ очевидно. Н приводят обычно в правой части
уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращенные
обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к — кристаллическое.
Эти символы опускаются, если агрегатное состояние веществ очевидно.
Если в результате реакции выделяется теплота, то  Н < 0. Учитывая
сказанное, составляем термохимическое уравнение данной в примере реакции: Н < 0. Учитывая
сказанное, составляем термохимическое уравнение данной в примере реакции:
PCl5(к) + H2O(г) = POCl3(ж) + 2HCl(г); ∆Hx.p.= -111,4 кДж
Таблица 15.
Стандартные теплоты (энтальпии) образования
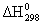 некоторых веществ некоторых веществ
|
Вещество
|
Состояние
|
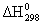 кДж/моль кДж/моль
|
Вещество
|
Состояние
|
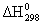 кДж/моль кДж/моль
|
|
С2Н2
|
г
|
+226,75
|
СО
|
г
|
-110,52
|
|
CS2
|
г
|
+115,28
|
СН3ОН
|
г
|
-201,17
|
|
NO
|
г
|
+90,37
|
С2Н5OН
|
г
|
-235,31
|
|
С6Н6
|
г
|
+82,93
|
H2O
|
г
|
-241,83
|
|
С2Н4
|
г
|
+52,28
|
Н2О
|
ж
|
-285,84
|
|
H2S
|
г
|
-20,15
|
NH4C1
|
к
|
-315,39
|
|
NН3
|
г
|
-46,19
|
СО2
|
г
|
-393,51
|
|
СН4
|
г
|
-74,85
|
Fе2О3
|
к
|
-822,10
|
|
С2Н6
|
г
|
-84,67
|
TiO2
|
к
|
-943,90
|
|
НС1
|
г
|
-92,31
|
Са(ОН)2
|
к
|
-986,50
|
|
|
|
|
А12O3
|
к
|
-1669,80
|
Пример 2. Реакция горения этана выражается
уравнением:
С2Н6(г) + 31/2О2=
2СО2(г)+3Н2О(ж); ∆Hх.р.=
-1559,87 кДж
Вычислите теплоту образования этана, если известны теплоты
образования СO2(г) и Н2O(ж) (см. табл. 15).
Предыдущая Следующая
|