Предыдущая Следующая
Пример 1. В каком состоянии
энтропия 1 моль вещества больше при одинаковой температуре:
в кристаллическом или парообразном?
Решение. Энтропия есть мера
неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы)
расположены упорядоченно и могут находиться лишь в определенных
точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо
больше объема 1 моль кристаллического вещества; возможность хаотичного движения
молекул газа больше. А так как энтропию можно рассматривать как количественную меру
хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества
больше энтропии 1 моль его кристаллов при одинаковой температуре.
Пример 2. Прямая или обратная
реакция будет протекать при стандартных условиях в системе
СН4(г)+СО2 ↔
2СО(г)+2Н2(г)
Решение. Вычислим  прямой реакции. Значения прямой реакции. Значения  соответствующих веществ приведены в табл. 16. Зная,
что соответствующих веществ приведены в табл. 16. Зная,
что  G есть функция состояния и что G есть функция состояния и что
 G для простых веществ, находящихся в
устойчивых при стандартных условиях агрегатных состояниях, равны
нулю, находим G для простых веществ, находящихся в
устойчивых при стандартных условиях агрегатных состояниях, равны
нулю, находим  процесса: процесса:
∆G0298 = 2 (-137,27) +2
(0) - (-50,79-394,38) = +170,63 кДж
То, что  > 0, указывает на невозможность
самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов равном
1,013 • 105 Па (760 мм рт. ст. = 1 атм). > 0, указывает на невозможность
самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов равном
1,013 • 105 Па (760 мм рт. ст. = 1 атм).
Таблица 16
Стандартная энергия Гиббса образования  некоторых веществ некоторых веществ
|
Вещество
|
Состояние
|
 , кДж/моль , кДж/моль
|
Вещество
|
Состояние
|
 , кДж/моль , кДж/моль
|
|
ВаСО3
|
к
|
-1138,8
|
FeO
|
к
|
-244,3
|
|
СаСО3
|
к
|
-1128,75
|
Н2О
|
ж
|
-237,19
|
|
Fе3O4
|
к
|
-1014,2
|
Н2O
|
г
|
-228,59
|
|
ВеСО3
|
к
|
-944,75
|
PbO2
|
к
|
-219,0
|
|
СаО
|
к
|
-604,2
|
СО
|
г
|
-137,27
|
|
ВеО
|
к
|
-581,61
|
СН4
|
г
|
-50,79
|
|
NaF
|
к
|
-541,0
|
NO2
|
г
|
+51,84
|
|
ВаО
|
к
|
-528,4
|
NO
|
г
|
+86,69
|
|
СО2
|
г
|
-394,38
|
C2H2
|
г
|
+209,20
|
|
NaCl
|
к
|
-384,03
|
|
|
|
|
ZnO
|
к
|
-318,2
|
|
|
|
Таблица17
Стандартные абсолютные энтропии 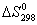 некоторых веществ некоторых веществ
Предыдущая Следующая
|