Предыдущая Следующая
Для реакции, протекающей по
уравнению А + В = С + Д, этот закон выразится уравнением:
V = kCA • CB (1)
где:
СА и СВ – молярные концентрации вещества А и
В;
k – коэффициент
пропорциональности, называемой константой скорости реакции.
Основной закон химической кинетики часто называют законом действующих масс.
Из уравнения (1) нетрудно установить физический смысл константы скорости k; она численно
равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют
1моль/л или когда их произведение равно единице.
Следует иметь в виду, что понятие скорости реакции относится к данной реакции,
а не к отдельным реагирующим веществам. Очевидно, что для каждой реакции при постоянной
температуре ее константа скорости будет величиной постоянной, и, следовательно,
зная k , можно сравнивать скорости химического взаимодействия различных
веществ: чем больше k , тем быстрее реагируют данные вещества. Константа скорости
реакции зависит от природы реагирующих веществ, температуры, присутствия катализатора,
но не зависит от концентрации вещества.
Уравнение (1), связывающее скорость
реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Для реакции, записанной в общем виде 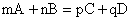 , кинетическим уравнением будет , кинетическим уравнением будет
V = kCmA
• CnB (2)
где: m и n – коэффициенты в уравнении реакции.
Уравнение (2) является общим алгебраическим
выражением закона действующих масс: скорость химической
реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых
в степенях, равных стехиометрическим коэффициентам соответствующих веществ в уравнении
реакции.
Основной закон химической кинетики не учитывает концентрации реагирующих
веществ в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь
на поверхности, которая остается неизменной. Так, например, для реакции горения угля 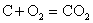 кинетическое уравнение
реакции имеет вид: кинетическое уравнение
реакции имеет вид:
V = kCC • SCo2
где: k – константа скорости;
СС – концентрация твердого
вещества;
Предыдущая Следующая
|