Предыдущая Следующая
“P” 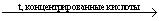 PO43- PO43- 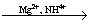 MgNH4PO4 (белый) MgNH4PO4 (белый)
Способы отщепления
ковалентно-связанного галогена с целью перевода его в ионное состояние
I. Проба Бельштейна (см. выше).
II. Сжигание в атмосфере кислорода.
Достоинства: можно
определить все галогениды, серу и фосфор, это метод количественного элементного
анализа (фотоколориметрия).
Суть метода:
окислительное расщепление. Элемент переводится в неорганический ион.
Используется для анализа плоскодонная коническая термостойкая колба со шлифом и
пробкой. В колбу наливают поглощающую жидкость, точную навеску анализируемого
вещества помещают в бумажный пакетик, который затем на нихромовом держателе
вносят в колбу. Заполняют колбу чистым кислородом. Поджигают кончик бумажки.
Колбу накрывают полотенцем и придерживают рукой. После окончания горения
оставляют на 1 час, постоянно перемешивают, чтобы продукты реакции перешли в
раствор. А из раствора определяют эти продукты титрованием, параллельно проводят
контрольный опыт с пустым пакетиком.
Определение
хлора и брома
1. Поглощающая
жидкость – 6% раствор перекиси водорода:
RCl 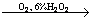 HCl + CO2 + H2O HCl + CO2 + H2O
2. Нейтрализуют
щелочью с бромфеноловым синим до синего окрашивания. pT = 3 – 6:
HCl + NaOH 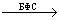 NaCl + H2O NaCl + H2O
3. Прибавляют 0,3% HNO3 до
желтого окрашивания. pH = 3:
NaCl + HNO3 à HCl + NaNO3
4. Проводят прямую
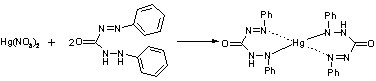
меркуриметрию с дифенилкарбазоном. Титрант: 0,1M Hg(NO3)2;
pH=2-3 (HNO3).
Индикатор: дифенилкарбазон: Ph-N=N-CO-NH-NH-Ph
Навеску растворяют в
воде и титруют до образования сине-фиолетового окрашивания.
Hg(NO3)2 + 2HCl à HgCl2¯ + 2HNO3
f(NaCl)=1; 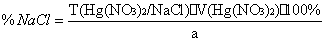
Определение
йода
1. Поглощающая
жидкость – 0,2М раствор NaOH:
RI 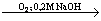 NaI + CO2 + H2O NaI + CO2 + H2O
Чтобы доокислить ион
йода добавляют ацетатный буфер и бромную воду (по каплям) в избытке (до желтого
окрашивания):
2NaI + Br2 à I2 + 2NaBr
NaI + Br2 à NaIO3
2. Избыток брома
удаляют с помощью HCOOH:
HCOOH + Br2 à HBr + CO2 + H2O
3. Проводят косвенную
йодометрию. К раствору прибавляют кристаллический KI, 0,05M H2SO4, ставят в темное место на 5 минут. Титруют
тиосульфатом с индикатором крахмалом.
2HIO3 + 10KI + 5H2SO4 à 6I2 + 5K2SO4 + 6H2O
I2+2Na2S2O3
à
2NaI + Na2S4O6
Предыдущая Следующая
|