Предыдущая Следующая
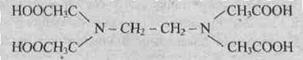
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений, называемых
комплексонами. Би- и полидентантные
лиганды при взаимодействии с комлексообразователями образуют замкнутые циклы, называемые
хелатными, поэтому и комплексы с би- и полидентантными лигандами называют хелатными
(или клешневидными), например
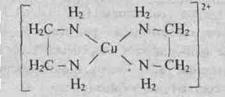
Пример
1. Определите заряд комплексного иона,
координационное число (к.ч.) и степень окисления комплексообразователя в
соединениях: a) K4[Fe(CN)6]; б) Na[Ag(NO2)2];
в) K2[MoF8]; г) [Сr(Н2O)2(NН3)3С1]С12.
Решение. Заряд комплексного иона
равен заряду внешней сферы, но противоположен ему по знаку. Координационное
число комплексообразователя равно числу лигандов, координированных вокруг него.
Степень окисления комплексообразователя определяется так же, как
степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления
всех атомов в молекуле равна нулю. Заряды нейтральных молекул (H2O,
NН3) равны нулю. Заряды кислотных остатков определяют из формул
соответствующих кислот. Отсюда:
|
|
Заряд иона
|
К.ч.
|
Степень окисления
|
|
а)
|
-4
|
6
|
+2
|
|
б)
|
-1
|
2
|
+1
|
|
в)
|
-2
|
8
|
+6
|
|
г)
|
+2
|
6
|
+3
|
9.4. Номенклатура
комплексных соединений. Название комплексного катиона
записывается одним словом, начинающимся с названия отрицательного лиганда с прибавлением
буквы «о», затем приводятся нейтральные молекулы и центральный атом с указанием
римской цифрой его степени окисления для металлов переменной валентности. Для молекул
Н2О (аква), NН3 (аммин), СО (карбонил),
NO (нитрозил) даются особые названия, указанные в скобках.
Число лигандов
обозначают греческими приставками (ди-, три-, тетра- и т.д.) или бис-, трис-,
тетракис-, пентакис- и гексакис- для 2, 3, 4, 5 и 6 соответственно у сложных лигандов. Например,
соединение [Zn(NH3)2Cl]CI
называется хлорид хлородиамин цинка (II), а [Ni(En)2]Cl2
– хлорид бис(этилендиамин) никеля (II).
Комплексный анион
записывается аналогично названию катиона, но с добавлением суффикса
-«am» к названию комплексообразователя,
например K2[Zn(CN)4] - тетрацианоцинкат (II) калия.
Нейтральный комплекс записывается подобно катиону, например
комплекс [Ni(CО)4] называется тетракарбонил никеля (II).
Соответственно по типу лигандов комплексы называют аквакомплексы
(лиганд Н2О), аминокомплексы (лиганд NH3), ацидокомплексы (лиганды анионы
кислот), комплексонатные комплексы (лиганды-комплексоны) и т.д.
Предыдущая Следующая
|